Las autoridades sanitarias españolas conceden la aprobación regulatoria a Sativex®, el primer tratamiento para la espasticidad asociada a la esclerosis múltiple (EM) de las últimas décadas.
Almirall, S.A. (ALM) y GW Pharmaceuticals plc (GWP: AIM) han anunciado que las autoridades sanitarias españolas han concedido la aprobación regulatoria a Sativex®i como medicamento complementario para el tratamiento de la espasticidad moderada a grave debida a la esclerosis múltiple (EM) en pacientes que no consiguen controlar este síntoma con su medicación actualii. Antes de su comercialización, Sativex® requiere la aprobación de precio y reembolso por parte del Ministerio de Sanidad español, proceso que está previsto finalice en el cuarto trimestre 2010.
Por otra parte, GW Pharmaceuticals ha iniciado los trámites de registro por el Procedimiento de Reconocimiento Mutuo (PRM) para la aprobación de Sativex® en otros estados miembros de la UE incluidos los principales mercados como Alemania, Francia e Italia. La agencia regulatoria del Reino Unido, Medicines and Healthcare product Regulatory Agency (MHRA), que aprobó Sativex® en junio de 2010, ha aceptado actuar como Estado miembro de referencia en este proceso de registro.
La lista completa de países adicionales para los que se solicita el PRM se está ultimando y se comunicará a la MHRA más adelante.
“Estamos muy satisfechos con la aprobación regulatoria de Sativex® en España, y confiamos poder ofrecérselo a los pacientes de nuestro país en el cuarto trimestre de este año. Sativex® satisfará una necesidad no cubierta en aquellos enfermos de esclerosis múltiple que se enfrentan a las limitaciones de la espasticidad y de otros síntomas asociados. Asimismo, nos complace haber iniciado el proceso regulatorio de reconocimiento mutuo de Sativex® para obtener su aprobación en otros mercados europeos clave y confiamos en poder contar con nuevas aprobaciones y lanzamientos el próximo año” afirma Luciano Conde, Director General Ejecutivo de Operaciones de Almirall.
Justin Gover, Director General de GW, comenta: “Si tenemos en cuenta la reciente aprobación y lanzamiento de Sativex® en el Reino Unido, esta aprobación regulatoria en España y la presentación de la solicitud de reconocimiento mutuo europeo marcan el inicio de la expansión internacional del producto. Sativex® satisface una importante necesidad médica para las personas con EM, y junto a nuestro socio Almirall, esperamos poner a disposición de los pacientes este medicamento en el resto de Europa”.
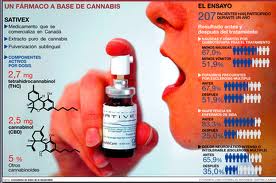
Sativex® -un modulador del sistema endocannabinoide- es el primero de una nueva clase de fármacos para el tratamiento de la espasticidad asociada a la EM. Se administra en forma solución para pulverización bucal (se aplica en el interior de la mejilla o debajo de la lengua) y tiene un régimen de dosificación flexible, lo que resulta especialmente adecuado dada la variabilidad tanto de la espasticidad como de la propia esclerosis múltiple, de un paciente a otro.
Sativex® ha sido desarrollado por la compañía británica GW Pharmaceuticals y será comercializado en Europa (excepto en el Reino Unido) por Almirall, S.A.
Procedimiento de Reconocimiento Mutuo (PRM)
En el PRM, la agencia regulatoria británica, la MHRA, actúa como estado miembro de referencia. Tras la presentación del PRM, la MHRA actualiza el informe de evaluación que constituyó la base de su reciente aprobación en el Reino Unido, y envía el informe a los países europeos seleccionados por GW. Se espera que la MHRA envíe el informe en aproximadamente 90 días y, en ese momento, GW / Almirall deben seleccionar la lista final de países que desean participar en el proceso. Las autoridades regulatorias de cada uno de los países incluidos formularán comentarios a los que la MHRA y GW se espera que respondan. Cada país puede tomar su propia decisión sobre la aprobación de Sativex®. En el caso de haber objeciones importantes en un determinado país, GW puede optar por retirar la solicitud de dicho país. El plazo del PRM depende de las interacciones entre las distintas autoridades y GW. El proceso puede tardar hasta un año en completarse.
Sativex®
Sativex® ha sido desarrollado por GW Pharmaceuticals plc como una respuesta específica a la necesidad de la población que padece de esclerosis múltiple de disponer de un medicamento de prescripción médica derivado del cannabis. Fabricado bajo la licencia del Ministerio del Interior del Reino Unido será comercializado en Europa (excepto en el Reino Unido) por Almirall.
Sativex® está indicado como tratamiento coadyuvante en los pacientes con espasticidad moderada o grave secundaria a la esclerosis múltiple, que no hayan respondido a otros medicamentos disponible para la espasticidad y en los que se observe una mejoría clínica significativa en los síntomas relacionados con la espasticidad en un primer ensayoii.
Sativex® contiene unos ingredientes activos denominados „cannabinoides?, que se extraen de plantas de cannabis cultivadas y procesadas en condiciones estrictamente controladas. Los cannabinoides reaccionan con los receptores cannabinoides que se encuentran en todo el organismo, incluido el cerebro.iii Un receptor de las neuronas del cerebro es un lugar donde ciertas sustancias se pueden unir durante un tiempo. Cuando esto sucede, la unión tiene un efecto sobre la célula y los impulsos nerviosos que produce, lo que provoca una mejoría de los síntomas de la espasticidad. En los pacientes que responden a Sativex®, este efecto es el que produce la mejoría en los síntomas de la espasticidad y el que les ayuda a enfrentarse a sus actividades diarias habituales.
La espasticidad
Hay casi 500.000 personas que sufren de esclerosis múltiple entre los cinco principales mercados de la UEv, y 40.000 de ellas viven en Españavi. La espasticidad es un síntoma definido por los pacientes y cuidadores como espasmos musculares, rigidez, rigidez y / o dificultad para moverse, y es uno de los síntomas más comunes de la EM, que se produce en hasta el 75% de las personas con EM. La espasticidad puede afectar a muchos aspectos de la vida diaria de los pacientes de EM, y es uno de los principales factores que contribuye de forma importante a su sensación de angustia y discapacidad.
Almirall
Almirall, una compañía farmacéutica internacional basada en la innovación y comprometida con la salud, cuya sede central está ubicada en Barcelona (España), investiga, desarrolla, produce y comercializa fármacos de I+D propia y de licencia con el propósito de mejorar la salud y el bienestar de las personas.
Las áreas terapéuticas en las que concentra sus recursos de investigación están relacionadas con el tratamiento de asma, EPOC (enfermedad pulmonar obstructiva crónica), artritis reumatoide, esclerosis múltiple, psoriasis y otras alteraciones dermatológicas.
Actualmente, los fármacos de Almirall están presentes en más de 70 países, con presencia directa en Europa y América Latina a través de 11 filiales.
GW
GW se fundó en 1998 y cotiza en el AiM, un mercado de la Bolsa de Valores de Londres, desde junio de 2001. Operando bajo la licencia del Ministerio del Interior británico, la empresa investiga y desarrolla productos farmacéuticos derivados del cannabis para pacientes que sufren dolencias graves, en particular, esclerosis múltiple y dolor oncológico. GW ha reunido un gran equipo de científicos con experiencia en cannabinoides, así como en el desarrollo de productos farmacéuticos de prescripción derivados de plantas y en medicamentos de prescripción médica que contienen sustancias controladas. GW ocupa una posición líder en el mundo de los cannabinoides y ha desarrollado una extensa red internacional con los científicos más relevantes en este campo.
Este comunicado de prensa puede contener declaraciones prospectivas de GW que reflejan las expectativas actuales respecto a eventos futuros, incluyendo el desarrollo y la aprobación regulatoria de sus productos. Las declaraciones prospectivas implican riesgos e incertidumbres. Los eventos reales podrían diferir materialmente de los proyectados en este documento y dependen de una serie de factores, incluyendo (entre otros), el éxito de las estrategias de investigación de GW, la aplicabilidad de los descubrimientos realizados, la conclusión exitosa y en el tiempo esperado de incertidumbres relacionadas con el proceso regulatorio y la aceptación de Sativex® y otros productos por los consumidores y profesionales de la medicina.














