En el capítulo anterior describimos las generalidades sobre el Sistema Cannabinoide Endógeno (SCE) y los cannabinoides naturales y sintéticos. En esta entrega comenzaremos el repaso sobre éstos últimos, utilizando como ejemplo el primer cannabinoide que fue sintetizado de forma artificial: el tetrahidrocannabinol (THC), discutiendo sobre las ventajas e inconvenientes que tiene este compuesto sobre la propia planta.
Aunque para nosotros sea algo cotidiano, el uso de fármacos tal y como lo entendemos en la actualidad es, desde un punto de vista histórico, una novedad muy reciente. Desde el principio de los tiempos hasta mediados del siglo XIX el tratamiento de las enfermedades se basaba en el uso de plantas y remedios naturales, cuya eficacia es incierta y muy variable en la mayoría de los casos. Es cierto que los principios activos de muchas plantas tienen propiedades terapéuticas, pero las plantas presentan varios inconvenientes para ser utilizadas como fármacos. Las variedades distintas de una misma especie pueden presentar concentraciones diferentes de los productos activos. Dentro de una misma planta pueden encontrarse, junto al compuesto deseado, otros que no tengan eficacia o que produzcan toxicidad. La disponibilidad de una planta puede depender de la climatología, existen dificultades para el transporte y la conservación, se presentan variaciones a lo largo del tiempo…). El desarrollo de la química industrial a principios del siglo XX permitió ir aislando los distintos principios activos que proceden del mundo vegetal, producirlos a gran escala, distribuirlos en la concentración más adecuada para que tengan efectos beneficiosos y conservarlos durante tiempo suficiente. El ejemplo más significativo lo tenemos en el uso de la corteza del sauce blanco, que fue descrito por Hipócrates en el siglo V a.C. como remedio para la fiebre y el dolor. Pero su principio activo (el ácido acetilsalicílico) no fue aislado hasta 1828 y su comercialización a gran escala (con el nombre de Aspirina® ) se produjo a principios del siglo XX. Y no fue hasta 1971 cuando se comprendió a nivel científico su mecanismo de acción: la inhibición de unas moléculas llamadas prostaglandinas y tromboxanos, responsables de la inflamación. Posteriormente y partiendo del modelo de las moléculas procedentes de los vegetales, la síntesis química puede producir productos derivados de éstos que sean más eficaces, menos tóxicos o más baratos.
Así, el desarrollo paralelo del conocimiento sobre cómo funciona el organismo y cuales son las causas de las enfermedades por un lado, y el de la química industrial aplicada a la farmacéutica por otro ha dado lugar a la aparición de los medicamentos tal y cómo los entendemos hoy en día. Desde luego la industria farmacéutica no es un negocio inocente y como cualquier otra empresa destinada a producir beneficios económicos tiene sus puntos oscuros. Pero el incremento radical en la esperanza de vida durante el s.XX, la drástica disminución de la mortalidad producida por las enfermedades infecciosas (incluyendo el SIDA) o de la mortalidad infantil se explica (entre otros factores) como la consecuencia de este tipo de avances.
La mayoría de las personas consideramos que para tratar la fiebre o una inflamación, es más eficaz tomar un antiinflamatorio que chupar la corteza de un sauce. Pero algunas corrientes sociales sostienen que “lo natural” es, por definición, más sano o asimilable por el organismo que “lo artificial o lo sintético”. La simpleza de esta argumentación es fácilmente desmontable si pensamos en las solanáceas, la Amanita phalloides o la estricnina, ejemplos más evidentes de la letalidad que puede encontrarse en el aparentemente idílico mundo vegetal. Lo natural es simplemente distinto de lo sintético y uno u otro serán preferibles dependiendo de múltiples factores. La preferencia de lo natural sobre lo sintético es una creencia, no un hecho científico demostrable.
Centrándonos en el cannabis, ya sabemos que su uso como fármaco está documentado desde hace más de 4000 años. El tratado medicinal chino Pên-Tsao Ching (2237 aC) lo describía como remedio contra el paludismo o el dolor, fue ingrediente común de las tríacas medicinales griegas y romanas y, en 1889, el clásico Manual de Medicina Merck recomendaba su uso en el tratamiento de la histeria, el delirio, la epilepsia, el insomnio nervioso, la migraña, la dismenorrea (dolor menstrual) o el dolor crónico. Si el cannabis hubiera sido una planta más, a lo largo del siglo XX hubiera experimentado el mismo proceso que otras plantas medicinales tradicionales: aislamiento y comercialización de sus principios activos, comprensión e investigación sobre sus mecanismos de acción y ajuste de sus indicaciones clínicas según la evidencia científica. Pero, en el caso de la planta del cáñamo, este proceso se vio truncado por la Prohibición. Por motivos más morales que médicos, el cannabis dejó de ser un vegetal como el resto desde los años 30 del siglo pasado para transformarse en “una droga”: sustancia muy tóxica, que crea adicción y que no tiene ningún interés terapéutico, por lo que, oficialmente, no merecía ser investigada. Pero la realidad ha resultado ser más tozuda que el afán legislativo prohibicionista. El cannabis ha seguido empleándose con fines terapéuticos y, a pesar de los retrasos y las dificultades, la investigación sobre los cannabinoides se ha ido abriendo paso. Probablemente el factor decisivo ha sido el interés de la industria farmacéutica en un mercado sin explorar pero lleno de aplicaciones potenciales, al menos desde un punto de vista teórico.
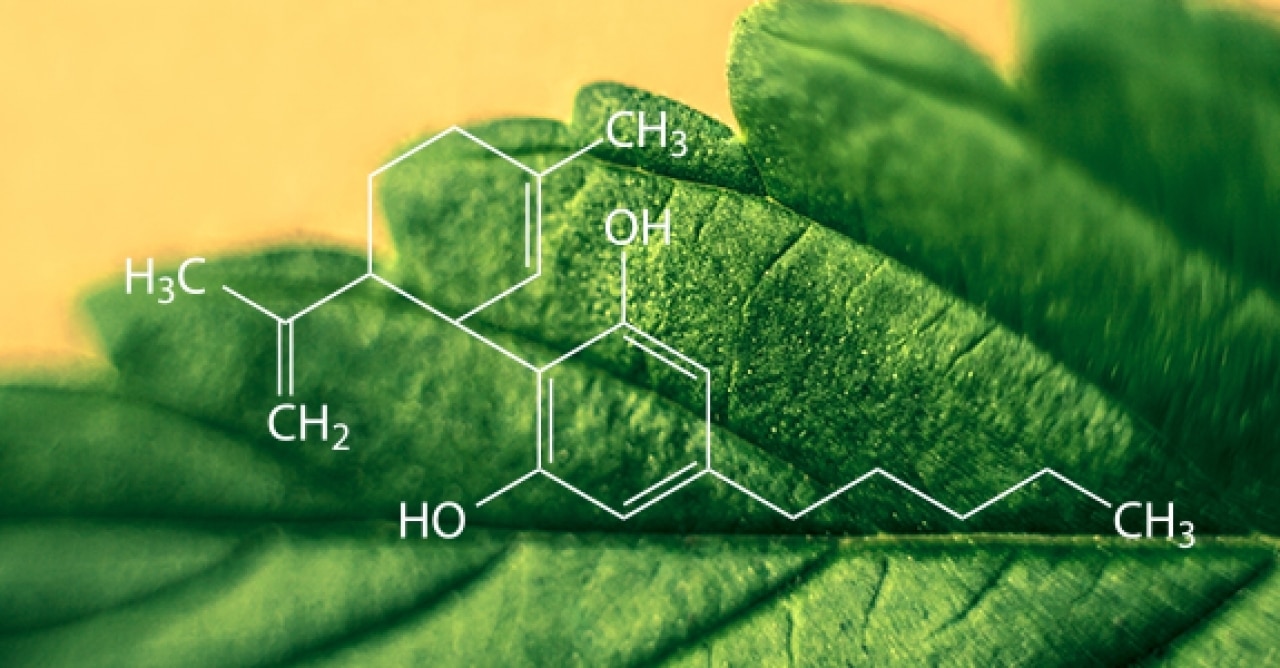
Aunque ya señalamos que en la planta del cannabis hay más de 400 principios activos distintos, muchos de ellos con actividad biológica comprobada, el delta-9-tetrahidrocannabinol (∆-9-THC) es el más característico de la planta y el responsable de muchos de sus efectos. Pues no fue hasta el año 1964 (hace un ratito desde una perspectiva histórica) cuando dos científicos israelíes, Yechiel Gaoni y Raphael Mechoulam del Instituto Weizmann de Ciencias en Rejovot, aislaron y describieron por primera vez la fórmula química de este compuesto de la planta. Hacia 1970 ya se había demostrado, a partir de experimentos en monos, que los efectos de la planta estaban producidos en gran parte por la acción del THC.

El paso siguiente fue la síntesis artificial del THC. La molécula tiene tres anillos de carbono entrelazados entre sí, lo que hace que su síntesis química sea muy compleja, requiera de múltiples precursores y trabajar con aparatos que utilizan presiones y temperaturas muy elevadas. Durante los años 70 se desarrollaron distintas rutas de síntesis para la molécula del THC y a finales de esa década el proceso fue técnicamente posible.. A esta forma sintética de THC, patentado y comercializado, se la conoce con el nombre de dronabinol.
Así, el dronabinol es una forma purificada y artificial del mismo THC que aparece de forma natural en la planta. Este compuesto químico está registrado con el nombre comercial de Marinol ® por un laboratorio belga (Solvay Pharmaceuticals) y en 1985 fue aprobada como tratamiento en las nauseas y vómitos producidos por quimioterapia por la FDA estadounidense y en el síndrome de caquexia-anorexia (delgadez extrema y falta de apetito) asociados al SIDA. Para ello tuvieron que hacerse varias modificaciones legales. El cannabis en Estados Unidos en una droga en Lista I, que es la calificación legal más restrictiva y prohibe su cultivo, compra, posesión y distribución. Pero su principio activo más importante, cuando se obtiene de forma artificial y se encapsula, se clasifica en “Lista III”, lo que permite su uso como fármaco. Se trata de una más de las situaciones surrealistas de una legislación antidroga absurda e ineficaz.
Aparte de las dos indicaciones ya señaladas (nauseas por quimioterapia y caquexia por SIDA), posteriormente se han encontrado otras utilidades para este fármaco. En 2007 un ensayo clínico sobre 30 pacientes demostró que, en pacientes con dolor crónico no tumoral en tratamiento con opiáceos (morfina o fentanilo), la adición de dronabinol mostraba mejores resultados en el alivio del dolor. También existen evidencias sobre su eficacia en el alivio de algunos síntomas de la esclerosis múltiple (rigidez, dolor y síntomas urinarios), así como en otros problemas neurológicos (esclerosis lateral amiotrófica, dolor después de traumatismo medular…). Además existen estudios científicos que han explorado los problemas de abuso, dependencia, cambio de personalidad o funcionamiento social en pacientes en tratamiento con dronabinol, y hay unanimidad en que éstos son excepcionales.
El THC sintético está disponible en forma de cápsulas de 2.5, 5 y 10 mg. Las cápsulas tienen una base gelatinosa y están recubiertas de una película de aceite de sésamo, con el objetivo de evitar que el fármaco se destruya si alguien pretende fumarlo. Esta forma de presentación y el elevado coste de la síntesis del THC sintético hacen que se trate de un fármaco muy caro: el coste de un tratamiento mensual puede oscilar entre los 200-800 euros dependiendo de la dosis. En realidad, el coste económico hace que la protección con aceite de sésamo sea innecesaria: nadie debería ser tan tonto como para fumarse una cápsula de dronabinol cuando un porro resulta muchísimo más barato, así que lo asumiremos como otra manifestación más del surrealismo antidroga ya comentado.
Además del precio, el inconveniente fundamental del THC sintético es que su administración se realiza por vía oral. Los cannabinoides son moléculas que no se diluyen bien en agua, y la cantidad de producto que se absorbe por el cuerpo varía dependiendo de muchos factores (sexo, edad, proporción de grasa corporal, si se han comido antes alimentos o no…) Esto da lugar a que existan muchas diferencias entre individuos para estimar la dosis correcta e incluso que una misma persona necesite dosis diferentes a lo largo del tiempo. Por otra parte, es frecuente la aparición de efectos adversos (cambios en el latido del corazón, mareo, incremento en el apetito, bajadas de tensión, sofocos, dolores musculares, conjuntivitis…) además de los propios efectos psicoactivos del cannabis. Es importante darse cuenta de que “lo deseado” en el uso recreativo del cannabis (sus efectos mentales) puede ser “no deseado” cuando nos referimos a la esfera de lo terapéutico. Teniendo en cuenta que los efectos psicoactivos del cannabis son de difícil control al utilizar la vía oral, la incidencia de episodios de ansiedad, desorientación, angustia, reacciones paranoides…al utilizar el dronabinol puede ser importante.
Todos estos inconvenientes hacen que las aplicaciones del dronabinol sean limitadas. De hecho no está aprobado en la Unión Europea, aunque podría accederse a él a través de un programa de uso compasivo de medicación extranjera, debidamente justificado ante las autoridades sanitarias. En ese caso, el médico debería rellenar unos formularios explicando que el dronabinol es la mejor opción disponible para el tratamiento de un paciente en el que el resto de recursos han fallado. Teniendo en cuenta sus limitadas aplicaciones, esta situación puede darse pero en la práctica parece muy poco frecuente..
El ejemplo del dronabinol nos muestra que, en este caso concreto, la forma sintética de un producto vegetal puede aportar pocas ventajas frente a la planta. La síntesis química consigue un producto puro y estandarizado, pero con un precio varios cientos de veces superior al de la planta, con una vía de administración que dificulta la dosificación, facilita la aparición de efectos adversos, y con unas aplicaciones prácticas muy limitadas para las que existen otros fármacos disponibles en el mercado. El mercado farmacéutico ha aprendido de estos errores. El fármaco más reciente derivado del cannabis es un extracto vegetal de plantas clonadas que se administra por vía sublingual. Así por un lado el coste de producción es mucho menor (aunque sigue siendo un fármaco caro) y por otro la vía de administración facilita una dosificación correcta.
En el próximo número seguiremos abordando los cannabinoides sintéticos en su vertiente terapéutica, centrándonos en dos moléculas que actúan sobre el sistema cannabinoide endógeno y que se han comercializado (con distinto éxito) en los últimos años: la nabilona y el rimonabant.
Acerca del autor
Muchos años luchando en la sombra para que el cannabis florezca al sol.