Con este capítulo terminamos el repaso a los cannabinoides sintéticos comerciales más significativos. En este número abordaremos los fármacos antagonistas del sistema endocannabinoide deteniéndonos en el representante más importante de la familia: el rimonabant.
Por el Dr. Fernando Caudevilla
Como ya hemos explicado previamente, el Sistema Endocannabinoide está compuesto de un conjunto de receptores (los llamados CB1, que aparecen en el Sistema Nervioso Central y los CB2, que se encuentran en el sistema inmunológico) a los que se unen de forma natural moléculas que producen las propias células (los llamados “ligandos endógenos”: la anandamida y el 2-araquidonilglicerol). Este Sistema se encuentra en todos los vertebrados y constituye la base científica sobre la que se sustentan los efectos psicoactivos del cannabis, así como sus usos terapéuticos. También es uno de los objetivos de investigación de las grandes compañías farmacéuticas al ser un campo nuevo de investigación de inmensas posibilidades.
Los primeros fármacos sintetizados de forma artificial buscaron imitar los efectos de los principios activos de la marihuana de forma más selectiva o buscando incrementar algunas de sus cualidades (sobre todo en lo que se refiere al dolor, la ganancia de peso o los vómitos) De hecho el primer fármaco comercializado no es más que una versión sintética del THC producido por la planta (el dronabinol, del que hablamos en el capítulo II de esta serie). Pocos años después se patentaron algunos fármacos que buscan estimular determinadas partes del Sistema Endocannabinoide, con el objetivo de maximizar los efectos terapéuticos y a los que ya hemos hecho referencia.
Se han comercializado otro tipo de fármacos que actúan sobre el Sistema Endocannabinoide. Pero antes de proseguir, es el momento de explicar que en farmacología se distinguen varios tipos diferentes de fármacos según sus efectos. Algunos de ellos se unen a receptores activándolos: es lo que se conoce como “fármaco agonista”. El dronabinol o la nabilona se comportan como agonistas del Sistema Endocannabinoide. Otros fármacos se unen a los receptores pero sin embargo no los activan, no producen sobre ellos ningún tipo de efecto: son los llamados “fármacos antagonistas”. Imaginemos un interruptor de luz conectado a una bombilla. Los fármacos agonistas actuarían activando el interruptor y encendiéndola. Los antagonistas, sin embargo, bloquearían el interruptor evitando su normal funcionamiento.
Los fármacos antagonistas pueden tener muchas aplicaciones en medicina. Imaginemos por ejemplo el caso de una persona que se ha intoxicado por heroína, morfina, codeína o cualquier otro fármaco opiáceo. Sus receptores estarán inundados por estas sustancias, que producen, entre otros efectos, somnolencia y depresión de las funciones respiratorias por lo que pueden ser mortales en sobredosis. Pero existe una sustancia, la naloxona, que se puede unir a los receptores opiáceos del cuerpo sin producir efectos, por lo que, en casos de sobredosis puede revertir los efectos de una intoxicación, ya que se unen a los mismos receptores que los opiáceos pero sin activarlos. Los fármacos antagonistas son de uso muy común, y están presentes en inhaladores contra el asma, antídotos contra sobredosis por fármacos o venenos, antihipertensivos, hormonas…
Así, sólo sería cuestión de tiempo que los científicos se pusieran a buscar sustancias que se unan a los receptores de los cannabinoides (como lo hacen los principios activos de la planta) pero sin producir efectos sobre ellos. En 1994 se descubrió el primer antagonista del Sistema Endocannabinoide, que tiene el complicado nombre de 5-(4-Clorofenil)-1-(2,4-diclro-fenill)-4-metil-N-(piperidin-1-il)-1H-pirazoli-3-carboxamida. Vamos, como para tener que aprendérselo de memoria…Lógicamente los descubridores le pusieron primero un nombre provisional más manejable (SR141716) y luego lo bautizaron como rimonabant, que es sin duda mucho más bonito.
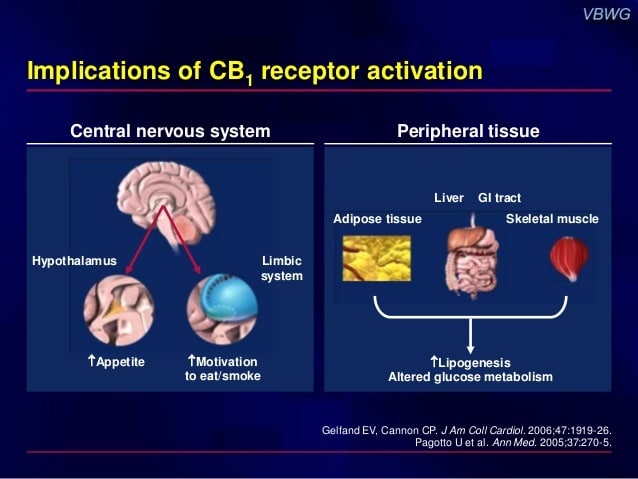
Los primeros ensayos clínicos en animales mostraban que el efecto más destacado del rimonabant era la disminución del apetito y la pérdida de peso. El cannabis y los cannabinoides incrementan la sensación de hambre, por lo que parece lógico pensar que un antagonista produzca el efecto contrario. Pero además se piensa que los cannabinoides tienen otros efectos de tipo metabólico (incrementan la resistencia a la insulina, bajan el HDL-colesterol (el conocido como colesterol bueno), además de incrementar el tiempo que los alimentos se encuentran en el intestino). Así, los fármacos antagonistas del Sistema Cannabinoide Endógeno podrían ayudar a perder peso disminuyendo el apetito por un lado, acelerando el tránsito intestinal por otro y actuando sobre la forma en la que el organismo asimila los alimentos. Teniendo en cuenta que la obesidad es una de las epidemias de nuestro tiempo el laboratorio parecía haber encontrado un fármaco realmente interesante que podría hacerles ganar mucho dinero.
También se llevaron a cabo estudios para comercializar rimonabant con otras aplicaciones. El Sistema Endocannabinoide regula funciones como la motivación y los circuitos de recompensa y se ensayó su utilidad en distintas adicciones. El tabaquismo es una de las adicciones más graves, y la que más mortalidad y daños para la salud produce a nivel global. El laboratorio propietario de la patente (el francés Sanofi-Aventis) comenzó en 2006 un gran ensayo clínico sobre 6.000 fumadores (Studies with Rimonabant and Tobacco Uses:STRATUS) para estudiar su eficacia en la dependencia a tabaco. El fármaco resultaba prometedor, ya que por un lado actúa sobre el sistema biológico que se supone que es el responsable del mantenimento de las adicciones. Y además tendría un efecto para evitar la ganancia de peso, uno de los efectos adversos que aparecen con mayor frecuencia al dejar de fumar. Los resultados fueron satisfactorios y un metaanálisis (un refrito estadístico que actualmente se considera la mejor prueba de la eficacia de un tratamiento) señalaba que rimonabant incrementaba en un 150% las probabilidades de éxito, y encima sin ganar peso.
La comercialización del fármaco (con el nombre de Acomplia®) fue complicada. La Food and Drug Administration (FDA) de Estados Unidos autorizó inicialmente su uso para la obesidad en Febrero de 2006 pero consideraba que no había datos suficientes sobre su seguridad en el tratamiento del tabaquismo. Posteriormente (Junio de 2007) presentó dudas sobre sus efectos adversos en relación con la obesidad y el laboratorio desistió de comercializarlo en aquel país.
En Europa, sin embargo, el proceso fue más sencillo y en Junio de 2006 la Agencia Europea del Medicamento autorizó su aprobación en los entonces 25 Estados de la Unión. El laboratorio no presentó el fármaco como “tratamiento contra la obesidad” sino como “tratamiento contra la obesidad asociada a síndrome metabólico”, es decir, aquellos obesos que tienen además diabetes, cifras altas de colesterol y otros factores de riesgo cardiovascular. Reino Unido fue el primer país en autorizarlo y posteriormente comenzó a venderse en Dinamarca, Irlanda, Alemania, Finlandia y Noruega. España fue uno de los primeros países europeos en aprobar su uso (el 27 de Junio de 2006), con el nombre comercial de Acomplia®.
Las cosas comenzaron a torcerse pocos meses después. Durante la fase de comercialización del producto empezaron a producirse una serie de casos de enfermedad psiquiátrica (episodios de depresión mayor, incluyendo intentos de suicidio). Estos casos ya se habían presentado durante los ensayos clínicos pero no parecían ser suficientemente importantes como para retirar el fármaco. En Junio del 2007, un año después de su aprobación, la Agencia Europea del Medicamento lanzaba una nota de prensa en la que advertía de que este fármaco no se debía recetar a personas con antecedentes de enfermedad psiquiátrica o que estuvieran en tratamiento con antidepresivos. Además, señalaba que había pedido al laboratorio información adicional sobre este aspecto de cara a evaluar la seguridad del fármaco. Estos datos fueron revisados por un comité independiente de expertos que concluyó que el riesgo de enfermedad psiquiátrica al tomar rimonabant se multiplicaba por dos. Entre Junio y Agosto de 2008 se declararon cinco casos de suicidios en personas que estaban en tratamiento con rimomabant, por lo que la Unión Europea decidió su suspensión en Octubre de 2008. Los problemas con rimonabant desanimaron a otros grandes laboratorios que estaban haciendo estudios con moléculas similares. Pfizer estaba desarrollando Otenabant (CP-945,598) también para el tratamiento de la obesidad. Merck había comenzado estudios en humanos con Taranabant (MK-0364) en humanos, pero desistió en 2008 ya que también se encontraron con casos de ansiedad y depresión y, vistos los antecedentes, su comercialización hubiera sido improbable
El caso del rimonabant ilustra la dificultad de separar los efectos físicos de los psicológicos cuando hablamos de los cannabinoides naturales o sintéticos. El Sistema Nervioso Central tiene muchos receptores para cannabinoides, y tanto la planta como los fármacos tienen efectos sobre ellos. La marihuana puede aliviar de forma eficaz las nauseas y vómitos de la quimioterapia pero produce efectos psicológicos potentes. Para algunas personas estos efectos son agradables pero, desde un punto de vista estrictamente farmacológico lo que se buscan son efectos selectivos sobre un síntoma o una enfermedad concreta. Con los antagonistas del Sistema Endocannabinoide parece suceder algo parecido. Bloquear el Sistema puede tener una serie de efectos deseados (disminuir el peso, ayudar a dejar de fumar) pero también tiene efectos sobre los receptores del cerebro que pueden manifestarse de forma peligrosa. El fármaco ideal sería aquel que active o desactive sólo determinadas partes del Sistema Cannabinoide Endógeno (las que tienen que ver con el dolor, el apetito, los vómitos…) y no actúe sobre la esfera psicológica.

De hecho esa es la nueva estrategia para la próxima generación de antagonistas del Sistema Endocannabinoide. El cerebro está recubierto de la barrera hematoencefálica, una fina película que impide que muchas sustancias lleguen a él y que constituye una especie de defensa natural contra tóxicos y agresiones externas. Los cannabinoides de la planta y los fármacos sintetizados hasta el momento la pueden atravesar fácilmente (por eso producen efectos psicológicos). Pero si se consiguen moléculas que actúen sobre los receptores de cannabinoides del organismo pero que no sean capaces de atravesar esa barrera es posible que puedan evitarse los efectos adversos de tipo mental. Un pequeño laboratorio danés llamado 7TM ha comenzado recientemente estudios con un cannabinoide de este tipo (otro nombre para un trabalenguas: 1-(2,4-Diclorofenil)-4-etill-5-(5-(2-(4-(trifluorometil)fenil)etinill)tiopen2-til)-N-(piperidin-1-il)-1H-pirazol-3-carboxamida), TM38837 para los amigos. Este fármaco ha demostrado sus efectos in-vitro (en cultivos celulares), en animales y ha comenzado sus primeros ensayos en humanos.
Con este artículo terminamos el repaso de cannabinoides sintéticos que han sido o están siendo utilizados como medicamentos. Pero el tema de los cannabinoides de síntesis tiene otro aspecto mucho más amplio e inquietante de cara a la Salud Pública. Los agonistas y antagonistas del Sistema Endocannabinoide se cuentan por cientos y algunos de ellos comienzan a ser vendidos como “marihuanas legales” o “sustitutos del cannabis” a través de Internet. El problema es que la mayoría de estas sustancias no han sido probadas nunca en humanos ni en animales y no se conocen sus riesgos o peligros. Juntemos esto con unas autoridades sanitarias y antidroga que no tienen ninguna credibilidad delante de los consumidores, añadámosle unas gotitas de sensacionalismo mediático y ya tienen ustedes un cóctel explosivo del que comenzaremos a hablar en el próximo número.
Acerca del autor